学术前沿 | 脊髓电刺激在直立性低血压中的临床应用
来自:学术前沿 日期:2025-11-20 09:50直立性低血压(Orthostatic Hypotension, OH)是一种由体位突然改变引发脑供血不足的疾病,诊断标准为站立后3分钟内收缩压下降≥20mmHg或舒张压下降≥10mmHg[1]。OH可分为神经源性直立性低血压(Neurogenic Orthostatic Hypotension,nOH)及非神经源性OH,其诊断和治疗往往需要多学科合作,发病原因与多种内外因素相关,包括自主神经失调、心脏疾病等,主要临床表现为头晕目眩、视力模糊、站立不稳,严重时可导致晕厥。其中,nOH患者的全因死亡风险远高于非神经源性OH患者[2]。本文主要对SCS治疗nOH的研究进行总结。
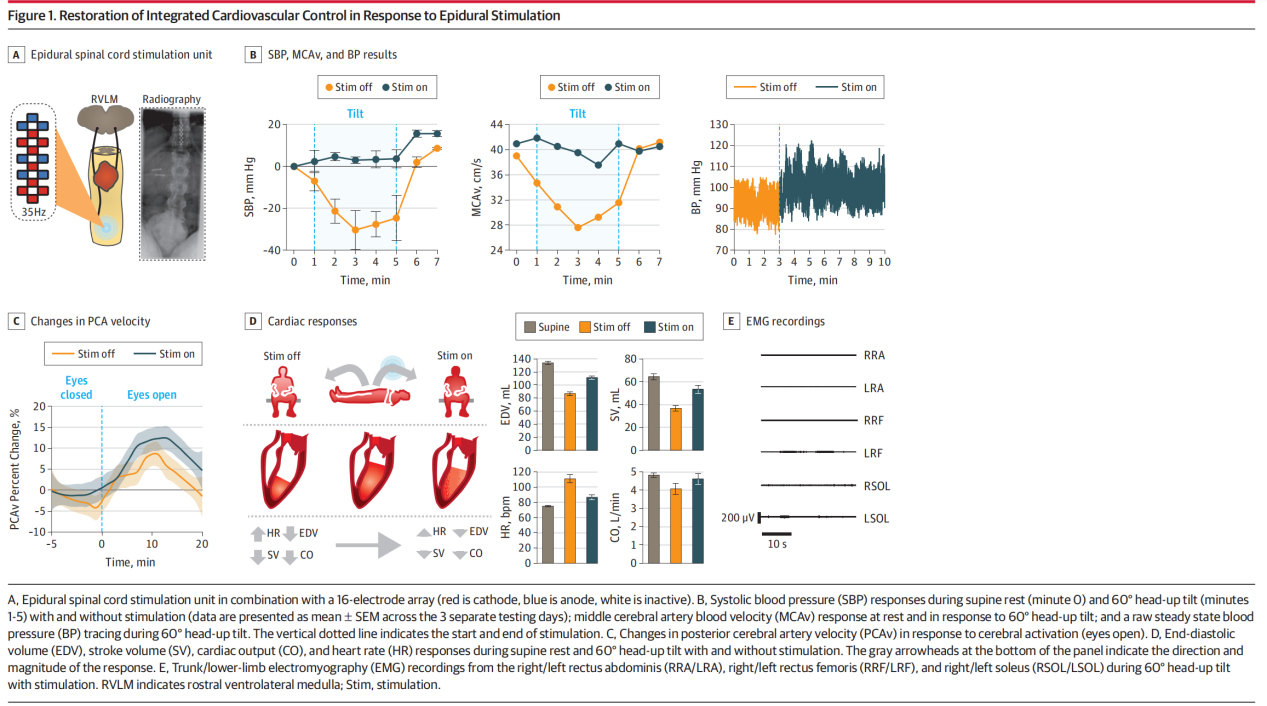
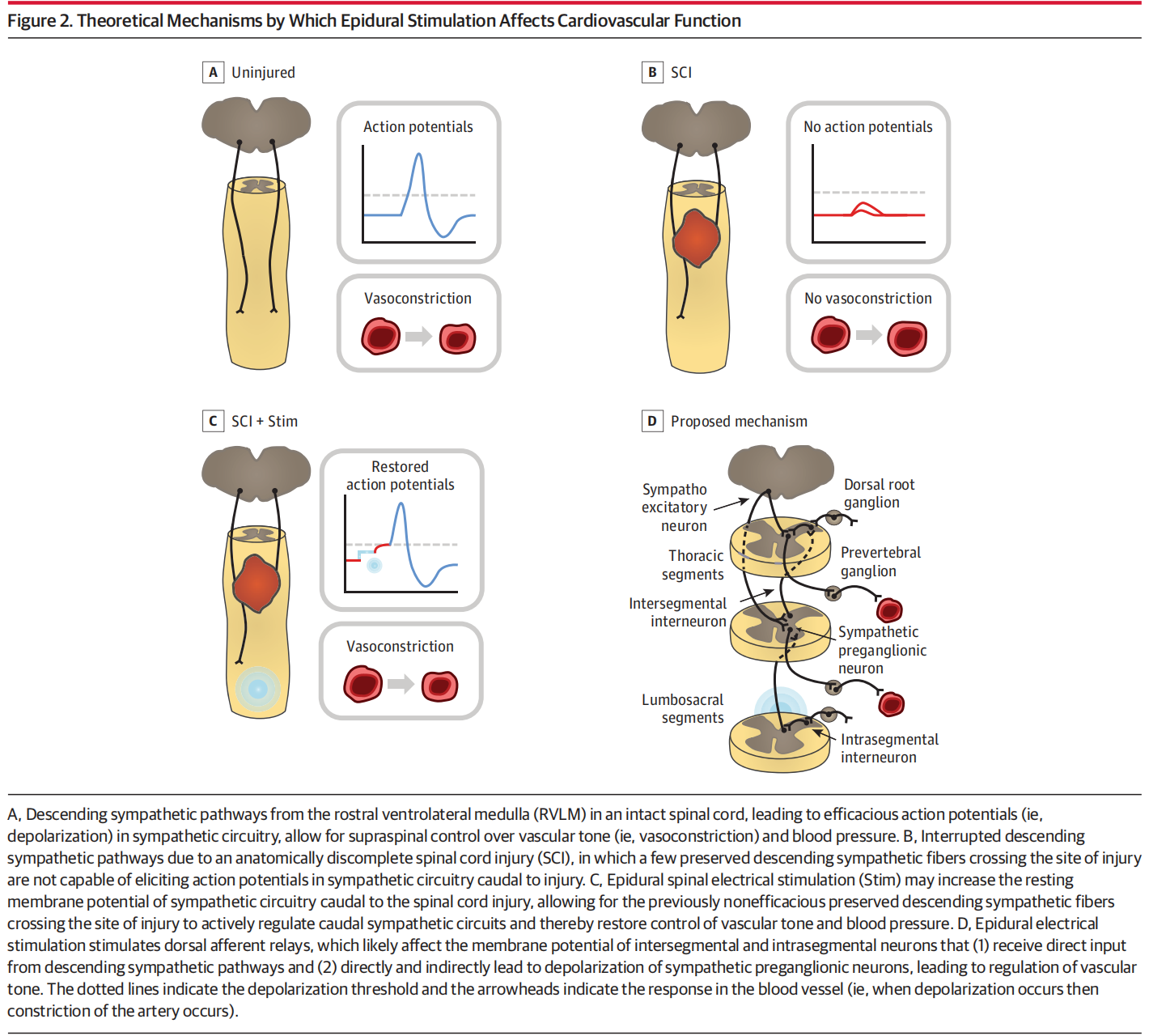
1.继发性神经系统损伤诱发nOH的研究 原发性神经系统退行性变和继发性神经系统损伤都会导致自主神经功能障碍进而引发nOH[3]。自主神经功能障碍常继发于神经系统创伤,其中脊髓受损(Spinal Cord Injury, SCI)便是典型代表。除运动性瘫痪外,慢性SCI还会导致多种不同的并发症,影响自主神经功能,导致血压不稳。随着硬膜外脊髓电刺激(Spinal Cord Stimulation, SCS)在SCI患者运动功能重建的研究中取得显著进展,其应用领域正逐步拓展至自主神经系统功能的调控[4]。 2018年,一项针对SCS对慢性C5-T4颈胸段SCI患者运动恢复的研究中,研究者为7名男性受试者在T11-L1椎体水平植入硬膜外电极,为促进了受试者的运动功能恢复,施加了频率15-35 Hz、电压2.4-7.5 V的电刺激[5]。在针对运动功能的研究和康复训练中,该团队发现针对腰骶部运动网络的脊髓电刺激能特异性地调节血压,SCS可将存在心血管缺陷的三名脊髓损伤患者站立时的平均血压,从无法耐受的70/45 mmHg显著提升至正常水平,成功消除nOH症状,对另外四名无nOH问题的患者血压则无不良影响。该研究提出来SCS的双重作用机制,既能通过引起肌肉收缩促进血液回流,也可直接激活脊髓中控制血管收缩的交感神经回路,从而稳定血压。 同年,一项单病例SCI后心血管功能障碍的研究指出,腰骶部硬膜外电刺激对改善直立性低血压等心血管问题具有显著效果[6]。研究为一名慢性颈段完全性SCI患者在T11-L1节段植入16触点5-6-5排列桨状电极,采用多模态监测,包括指端光电容积脉搏波法测血压、经胸超声心动图评估心脏功能、经颅多普勒测脑血流、肌电图监测下肢肌肉活动;在仰卧位及60°头高位倾斜状态下,分别测试刺激(35Hz频率、300ms脉宽、3.5V幅度)与无刺激时的指标,并在3个独立日重复验证血压变化。 该研究探讨了SCS血压调控机制,即硬膜外电刺激可通过调节交感神经环路的膜电位,恢复上位神经对血管张力和血压的控制。为SCI患者心血管功能障碍提供了新的治疗思路,硬膜外刺激可作为药物治疗的补充手段,提升SCI后血压异常患者的生活质量。 2022年,瑞士洛桑联邦理工学院Courtine教授和加拿大卡尔加里大学Phillips教授的研究团队,设计了靶向胸段脊髓后根的硬膜外电刺激方案以探索SCS血压调节机制[7]。研究人员在大鼠、非人灵长类模型上从T6到L1逐个节段进行刺激,发现刺激引发的升压反应呈高斯分布,其峰值集中区域被称为“血流动力学热点”。人类身上存在相似解剖区域,最佳刺激靶点为下胸段T10-L1节段。在一例人类受试者中,于T10和T11椎体水平植入5-6-5桨状电极,并采用“内正外负”的多极刺激策略,可特异性激活下胸段背根传入纤维,显著提升血压并增强交感神经活性。随着刺激强度的增加,血压呈现剂量依赖性的阶梯式上升趋势。相比之下,其他神经根刺激方案所引发的升压反应均较微弱,此外,采用“外正内负”配置刺激脊髓后柱时,则未能引起显著的升压效应。 2.原发性神经系统损伤诱发nOH的研究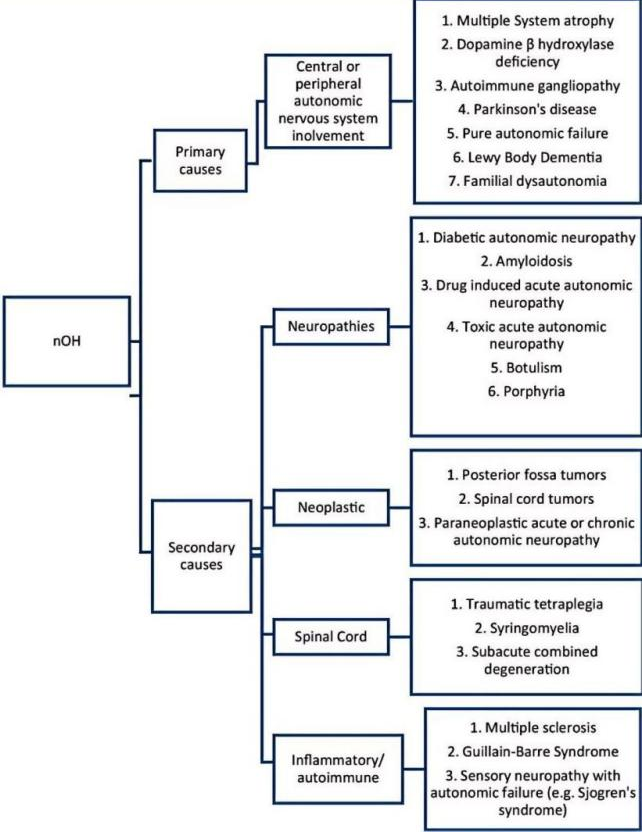
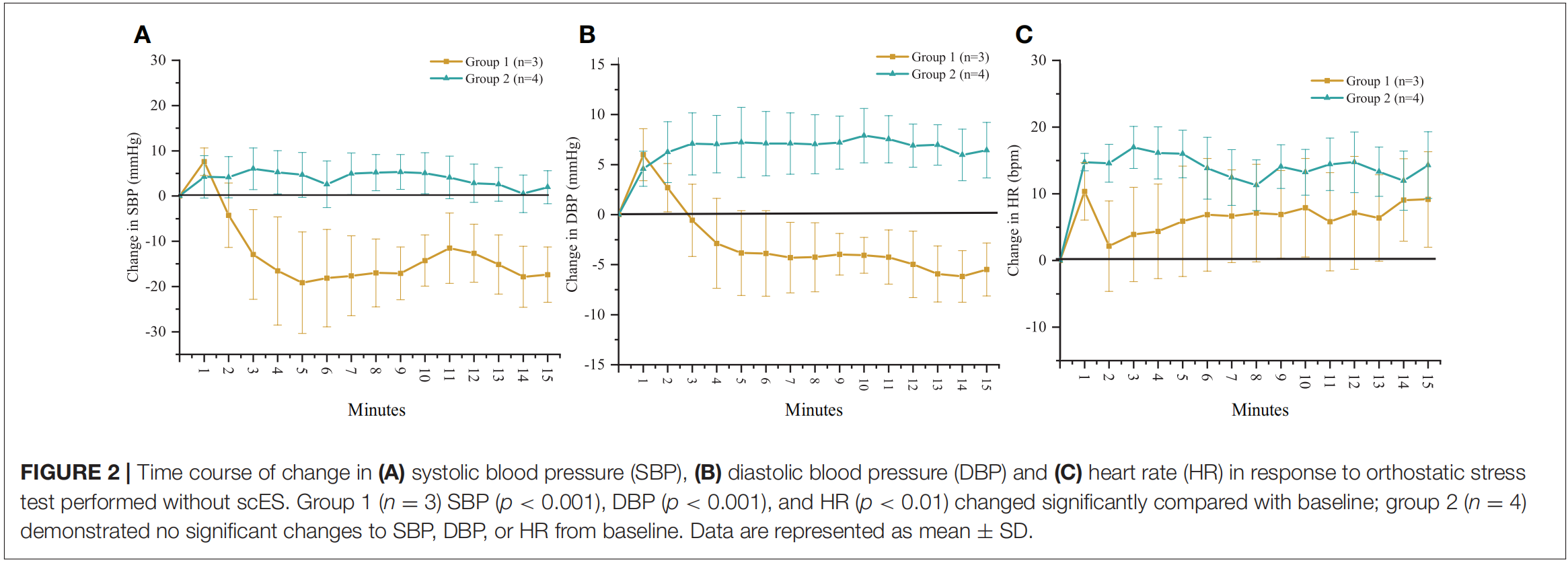
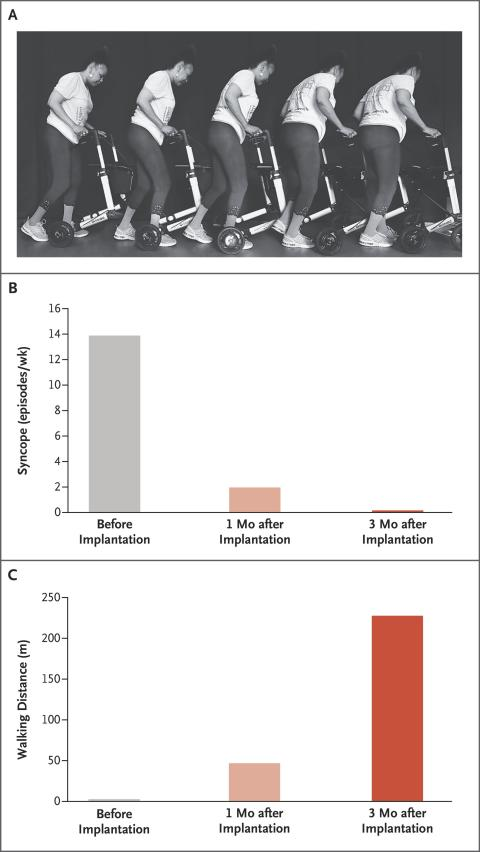
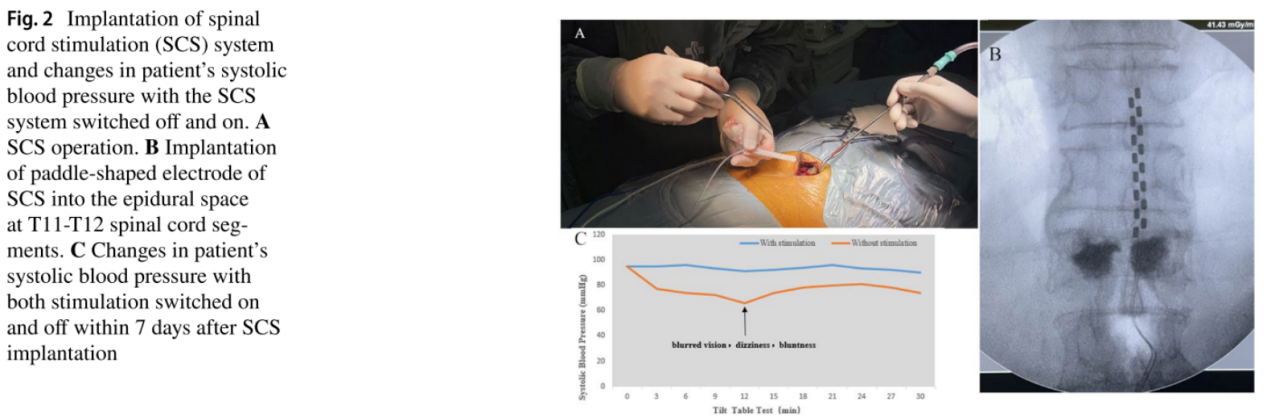
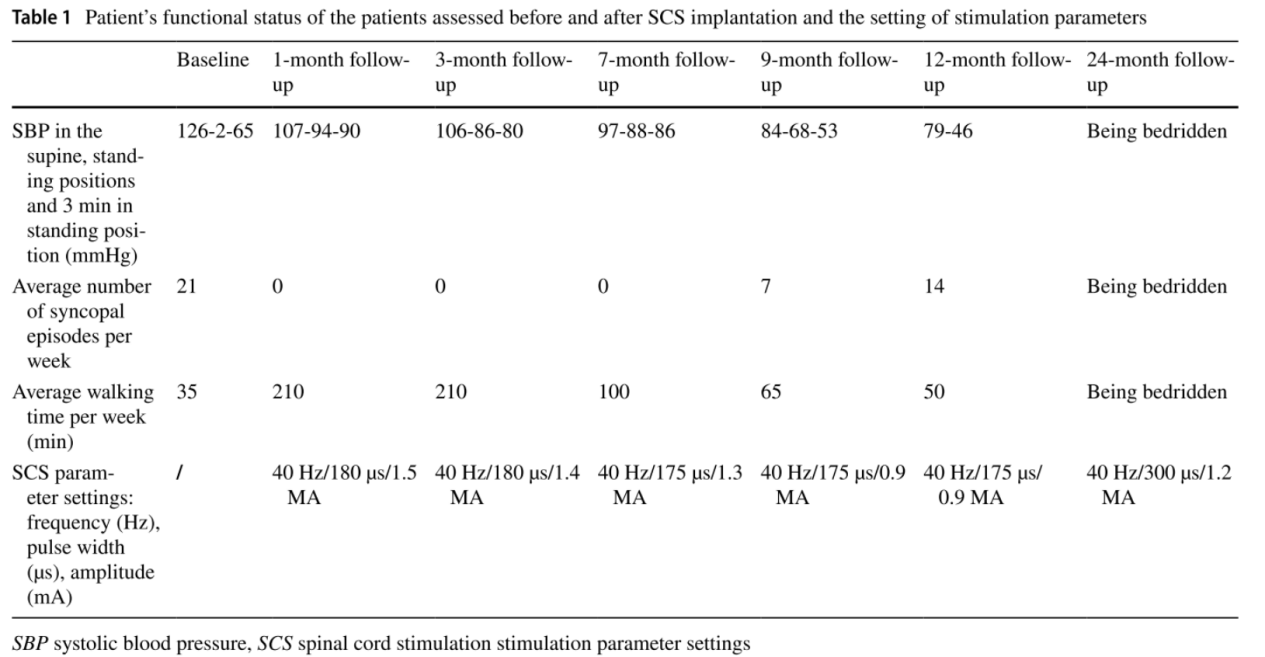
多系统萎缩(Multiple System Atrophy, MSA)是一种严重的原发性神经系统退行性疾病,严重损害自主神经系统,导致心血管自主神经功能障碍,影响血压稳定性,导致严重的nOH。2022年,NeuroRestore研究中心首次对一例MSA合并重度神经源性体位性低血压的病例进行了报道[8]。研究者通过T10-T11椎板切除术在硬膜外植入16触点5-6-5桨状电极,采用100 Hz频率、500μs脉宽、0-10 mA电流的刺激参数,通过闭环系统根据体位变化自动调节强度,靶向胸髓背根入髓区以改善体位性低血压。 术后评估显示,多次编程优化后的刺激器使患者在倾斜台测试中能够无症状耐受10分钟直立,而术前仅能维持1分钟。此外,动态血压监测证实日间仰卧位收缩压从111 mmHg升至128 mmHg,直立后血压下降速度显著延缓,从-48 mmHg/min降至-13 mmHg/min,晕厥发作完全消失,步行距离从数米提升超250m,且自主神经功能测试显示汗液分泌改善,在为期8个月的随访期内未出现手术相关并发症。 2025年,中国航天中心医院首次报道了SCS治疗从纯自主神经功能衰竭(Pure Autonomic Failure, PAF)转化为MSA患者的临床应用[9]。术前该患者病情严重,直立位血压仅为50-65/30-40 mmHg,无法站立超过30秒。研究采用SCS刺激靶点为T11-T12脊髓节段,参数设置为频率40Hz,脉冲宽度175-300µs,振幅0.9-1.5mA。 试验设置的评估指标包括不同体位血压测量、每周晕厥发作次数、行走时间和血浆去甲肾上腺素水平。结果显示,SCS对重度神经源性直立性低血压具有明显改善作用,最佳治疗效果持续约9个月。研究表明,SCS可能通过激活交感神经回路,增加外周血管阻力和血压来发挥作用。建议在疾病早期、运动功能尚未严重受损时进行SCS治疗,可能获得更持久的疗效。 3.最佳刺激位点的确定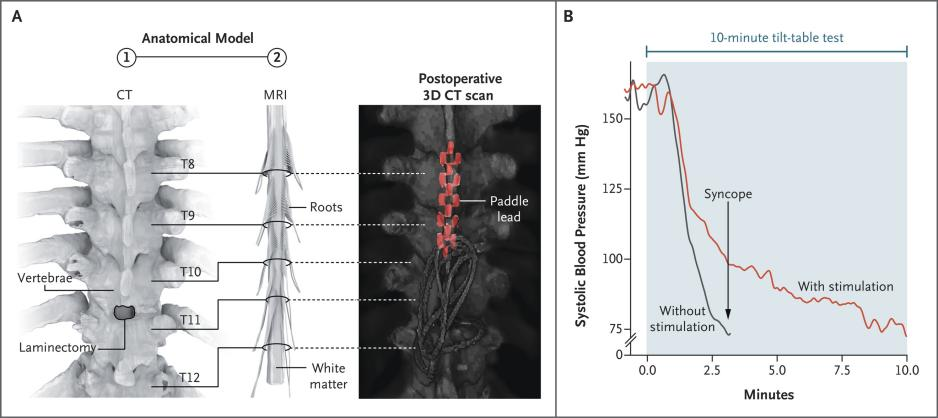
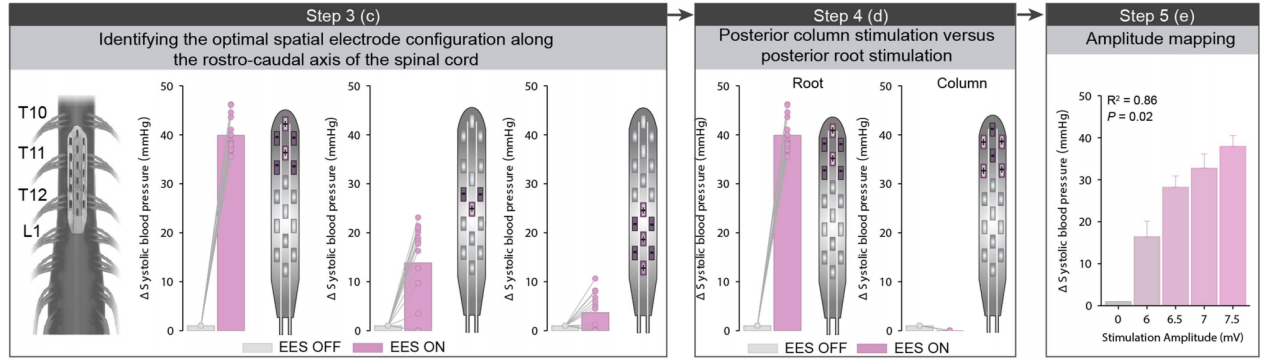
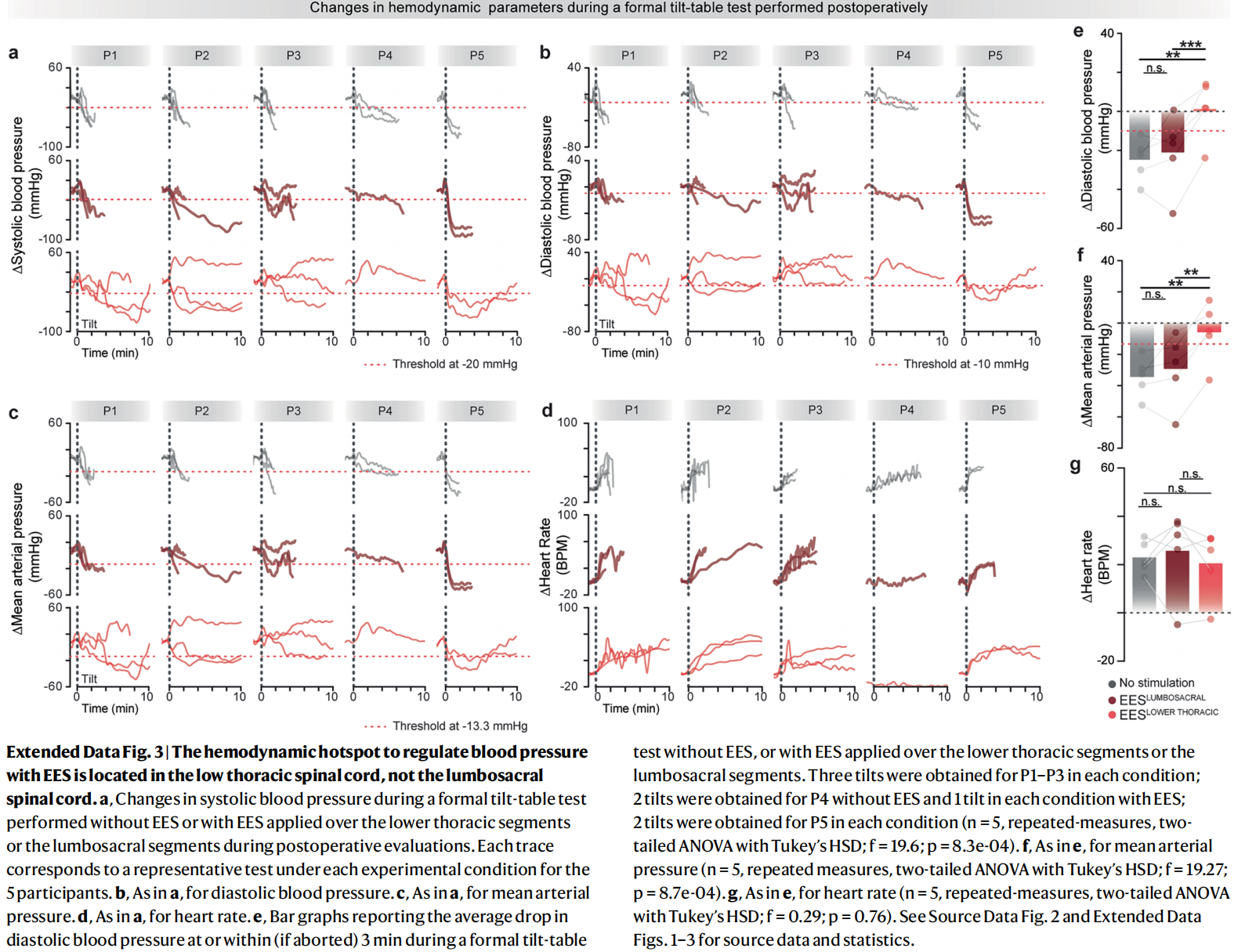
SCS治疗nOH的研究一直围绕着腰骶段和胸段脊髓的有效性进行,为确定最佳位点,2025年,一项多中心研究通过对照植入和“头对头”比较,得出来较为可靠的结论[10]。该试验为同一名受试者同时植入两个电极,一个置于下胸段“T10-T12”血流动力学热点,另一个置于腰骶段。同一受试者交替激活置于下胸段和腰骶段的两个电极,刺激参数统一为频率120Hz、脉宽300μs,幅度按个体阈值调整。术中测试采用逐对电极刺激,动脉导管连续记录血压并同步记录下肢肌电,结果显示,胸段在T11附近会产生强且集中的收缩压升高现象,而腰骶段在相同强度下易诱发下肢肌肉活动或痉挛。术后测试在患者清醒状态下进行70°倾斜台试验并进行连续血压监测,结果显示,胸段刺激可显著延长患者耐受时间,并快速稳定提升收缩压,刺激幅度与血压呈高度线性,而腰骶段效果则不稳定且易引发副反应。 4.总结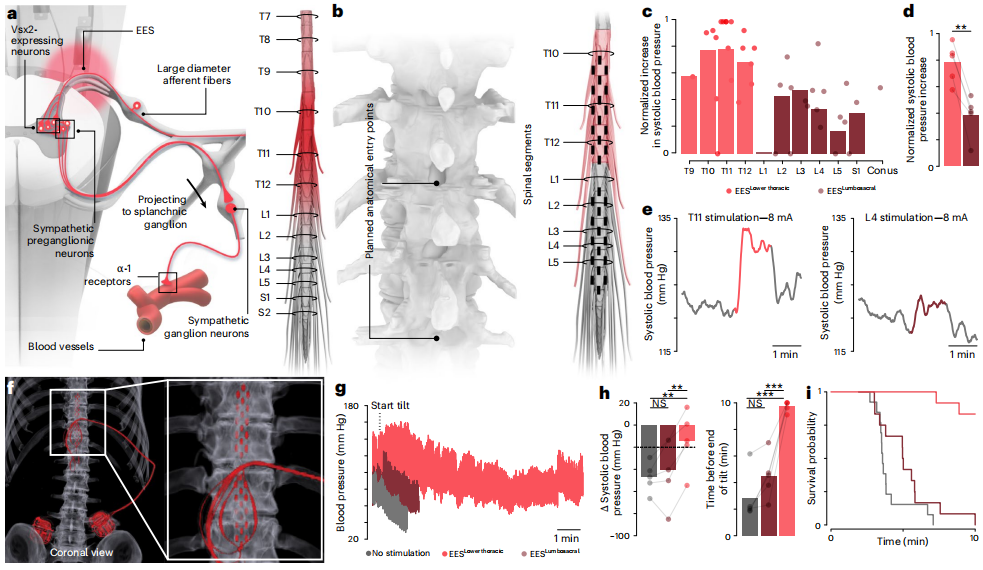
SCS是治疗药物难治性严重直立性低血压的一种有效的神经调控疗法,能显著改善患者的症状和生活质量。治疗普遍采用5-6-5桨状电极,植入位置覆盖T10-T12脊柱节段,采用频率范围为15-400 Hz,脉宽为120-350μs,并利用“外负内正”的多触点配置选择性地激活背根传入纤维,从而调制中枢自主神经回路以稳定血压。 尽管SCS治疗nOH的研究的样本量较小,但多项研究的结果都证实该方法可显著改善患者的血压,提高生活质量。随着闭环SCS的研究进展,未来可通过实时监测生理信号作为反馈,动态地调整刺激参数,实现更为精准的血压控制,在临床应用中具有广阔的前景。
参考文献:
[1]JOSEPH A, WANONO R, FLAMANT M, et al. Orthostatic hypotension: A review[J/OL]. Néphrologie & Thérapeutique, 2017, 13: S55-S67. [2]中国老年保健医学研究会晕厥分会,中华医学会神经病学分会帕金森病及运动障碍学组,刘文玲,陈海波,王含,李凡,陈琦玲,杨进刚,张海澄,浦介麟,丁岩,万志荣.直立性低血压诊断与处理中国多学科专家共识[J].中国循环杂志,2024,39(11):1058-1069 [3]KALRA D K, RAINA A, SOHAL S. Neurogenic Orthostatic Hypotension: State of the Art and Therapeutic Strategies[J/OL]. Clinical Medicine Insights: Cardiology, 2020, 14: 117954682095341. [4]BURNS M, SOLINSKY R. Toward rebalancing blood pressure instability after spinal cord injury with spinal cord electrical stimulation: A mini review and critique of the evolving literature[J/OL]. Autonomic Neuroscience, 2022, 237: 102905. [5]ASLAN S C, LEGG DITTERLINE B E, PARK M C, et al. Epidural Spinal Cord Stimulation of Lumbosacral Networks Modulates Arterial Blood Pressure in Individuals With Spinal Cord Injury-Induced Cardiovascular Deficits[J/OL]. Frontiers in Physiology, 2018, 9: 565. [6]WEST C R, PHILLIPS A A, SQUAIR J W, et al. Association of Epidural Stimulation With Cardiovascular Function in an Individual With Spinal Cord Injury[J/OL]. JAMA Neurology, 2018, 75(5): 630. [7]SQUAIR J W, GAUTIER M, MAHE L, et al. Neuroprosthetic baroreflex controls haemodynamics after spinal cord injury[J/OL]. Nature, 2021, 590(7845): 308-314. [8]SQUAIR J W, BERNEY M, CASTRO JIMENEZ M, et al. Implanted System for Orthostatic Hypotension in Multiple-System Atrophy[J/OL]. New England Journal of Medicine, 2022, 386(14): 1339-1344. [9]ZHAO J, ZHAO M, CHEN J, et al. Sustained therapeutic effect of spinal cord stimulation on improving severe neurogenic orthostatic hypotension in a patient with pure autonomic failure converting to multiple system atrophy[J/OL]. Journal of Neurology, 2025, 272(2): 177. [10]PHILLIPS A A, GANDHI A P, HANKOV N, et al. An implantable system to restore hemodynamic stability after spinal cord injury[J/OL]. Nature Medicine, 2025, 31(9): 2946-2957.