学术前沿 | 脑深部电刺激闭环系统:数据驱动型调控策略
来自:学术前沿 日期:2025-09-15 17:29
关键信息速览
脑深部电刺激术(DBS)已彻底革新帕金森病(PD)等运动障碍性疾病的诊疗范式。随着DBS技术创新与临床研究的突破,自适应脑深部电刺激(aDBS)系统应运而生,其通过闭环控制架构实时感知生理性生物标志物(如β频段振荡),实现精准神经调控与个体化治疗方案的动态优化。
本文系统评述aDBS领域四大核心进展:生物标志物精准识别技术、闭环控制策略开发、疗效机制解析及基于人工智能的神经解码技术。对数据驱动方法的研究已经将生物标志物检测扩展到皮层下β振荡之外,利用其他神经和运动学信号。未来多模态生物标志物输入的aDBS系统有望突破β振荡驱动疗法的局限性,显著提升对帕金森病治疗的效果。
前言 脑深部电刺激(DBS)向特定脑网络输送电刺激以调控神经系统疾病。连续DBS(cDBS)以开环方式提供恒定的、预设程序的刺激;它对正在变化的神经活动以及行为变化无响应。尽管cDBS已被证明是症状管理的重要进步,但它受限于固定的刺激参数设置,缺乏对波动症状和神经活动的实时适应性。这种“一刀切”的方法推动了自适应DBS(aDBS)的发展,该方法将疾病状态的相关神经或行为生物标志物整合为控制策略算法的输入,该算法根据生物标志物调整DBS参数。其结果是产生更个体化、更节能、更灵活的治疗方法,能在最大化减轻症状的同时最小化不良反应。本综述概述了相关生物标志物的多样化,以及用于帕金森病(PD)的aDBS的基本组成部分和控制策略。作者探讨了aDBS可能的疗效机制,并强调了当前aDBS方法的局限性;讨论了定量运动评估,这些评估催生了通过人工智能进行生物标志物解码的数据驱动方法;最后,展望未来,数据驱动方法的潜在应用有望改善医疗从业者和患者的临床与研究体验。 神经和行为生物标志物
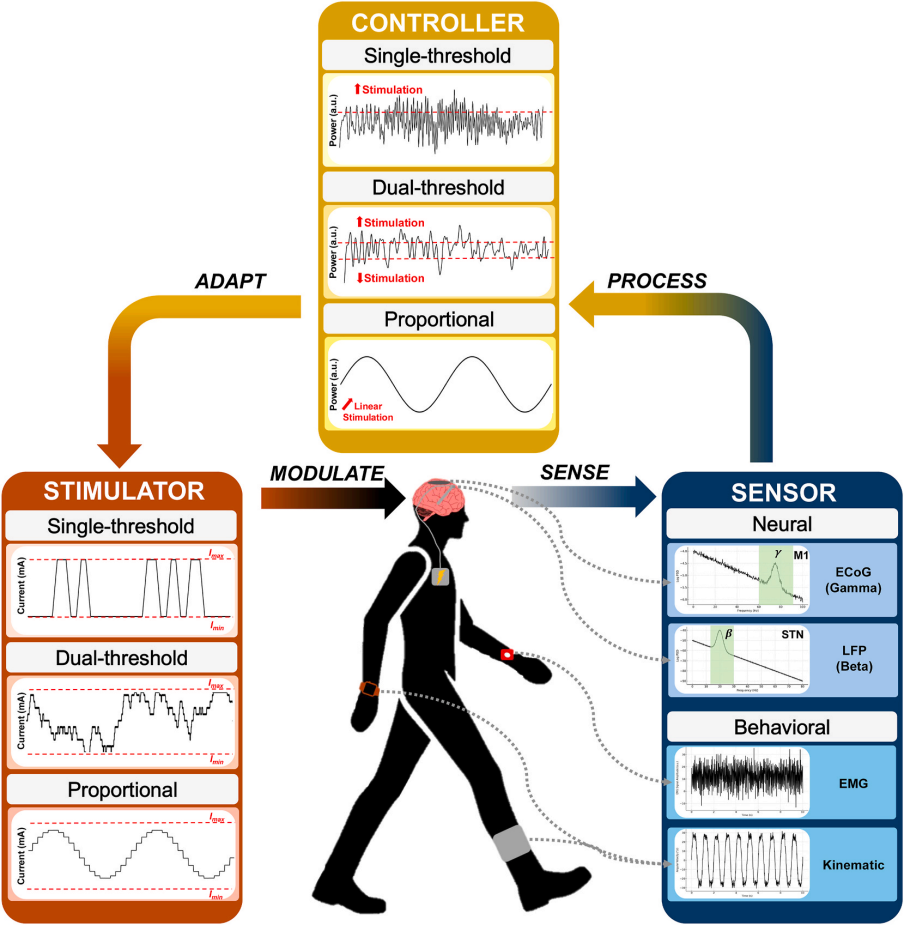
既往文献研究了作为运动障碍aDBS输入的神经和行为生物标志物。当前相关的神经生物标志物涉及皮层下和皮层信号。局部场电位(LFP)信号代表由植入电极记录的电活动。皮层下LFP可通过长期植入的DBS电极从丘脑底核(STN)、苍白球内侧部(GPI)或腹侧中间核(VIM)记录。在已确诊的帕金森病患者(PwP)中,皮质-基底节环路中监测到的过度β(13-30Hz)振荡活动(称为病理性β振荡活动)被发现是帕金森综合征的神经生理学生物标志物。具体而言,静息状态下STN中β频带能量增加、β频带爆发持续时间延长以及β同步性增加,均与帕金森病的运动功能减退相关。STN低β活动(13-20Hz)可能反映基底节内运动神经回路的活动状态,已有研究表明该活动可被药物治疗减弱。STN高β活动(20-35Hz)通过超直接通路参与与运动皮层的耦合,并可能与步态冻结(FOG)相关。与无冻结步态者相比,伴有FOG的帕金森病患者在正常行走和冻结发作期间STNβ频带爆发持续时间更长。双侧感觉运动网络的β波同步化与运动迟缓程度相关。多巴胺能药物和STN核团电刺激均能减弱β频带能量并缩短β频带爆发持续时间,且减弱程度与运动迟缓和强直的改善程度相关。在肌张力障碍期间,STN和GPi的其他皮层下LFP在α/θ(4-13Hz)、β和γ(30-100Hz)频带同步。相关的皮层生物标志物可通过在运动皮层植入电极阵列进行皮层脑电(ECoG)记录。运动皮层的窄带γ振荡(60-90Hz)与异动症的表现相关。贯穿皮质-丘脑底核环路的θ频带(3-7Hz)振荡活动与肌张力障碍相关,并且可被DBS减弱。来自外周传感器的行为标志物也可作为aDBS的输入信号。从可穿戴设备(如惯性测量单元IMU)获得的运动学信号可提供运动疾病行为的测量,如步态障碍、FOG和震颤。运动和体表肌电(sEMG)记录可分别检测和预测PD静止性震颤和特发性震颤的发作。这为运动学自适应脑深部电刺激(KinematicaDBS,简称KaDBS)奠定了基础。该技术通过实时行为状态动态调整刺激参数。随着多种神经与行为生物标志物的发现,整合疾病症状多维度生物标志物的自适应脑深部电刺激系统展现出巨大潜力,有望实现更精准的治疗方案。 aDBS的组成和控制策略
组成: 自适应脑深部刺激(aDBS)的疗效取决于对生物标志物的精准检测,并通过适配的控制策略动态调整刺激参数。该系统由以下三大核心组件构成: 生物信号传感器:神经自适应性脑深部电刺激(NaDBS)的输入源为植入电极监测的神经电信号(如β频段振荡),而运动自适应性脑深部电刺激(KaDBS)则整合运动传感器捕捉的行为信号(如步态冻结事件)。 闭环控制器:基于强化学习框架解析生物标志物与临床症状的关联度,生成刺激参数调控规则。 多通道刺激器:根据控制器闭环逻辑输出个体化刺激参数,如幅度、频率、刺激触点等等。 调制后检测到的反馈信号随后被输入至闭环控制系统并进行实时处理,形成闭环。 控制策略: 自适应脑深部刺激(aDBS)的核心控制策略主要采用单阈值、双阈值及比例控制算法。每种控制策略需对目标生物标志物进行差异化分类,并对应特定的刺激响应模式,从而形成不同类型的闭环调控模式。 单阈值控制策略:通过设定单一生物标志物阈值,当检测值高于或低于阈值时分别触发刺激强度的增减。该策略基于快速时间尺度(毫秒级)直接响应病理性神经活动(如持续性β波爆发),在植入式与外置式系统中均表现出良好的安全性、耐受性及有效性。 双阈值控制策略:通过设定生物标志物的上限和下限,也被证明具有良好的耐受性和有效性。当生物标志物分别高于上限阈值或低于下限阈值时,刺激幅度增加或减少,处于中间值时幅度保持稳定。这种控制策略主要应用于中慢时间尺度(低于0.1mA/s),用于平滑因药物剂量变化或症状严重程度波动引起的β能量波动。 比例控制策略:将刺激幅度与生物标志物幅度成比例地调整。这种控制策略的响应时间也较慢,因此特别适合于应对与药物相关的波动。 各控制策略之间的权衡与优化: 耐受性:单阈值控制策略的快速爬坡率(>1mA/s)易引发感觉异常或肌肉震颤,而双阈值/比例控制策略通常使用更缓慢的爬坡率( 噪声和伪影:单阈值控制策略的快速响应特性还可能导致生物标志物测量中的噪声增加,并容易受到刺激伪影的影响。双阈值和比例控制策略能够实现更稳定的生物标记物测量,但代价是调节速度较慢。 安全性阈值设定:对于所有控制策略而言,确定安全有效的振幅限值和爬坡速率至关重要——这既能确保在最低振幅水平下提供有效治疗刺激,又能避免因过度刺激或刺激振幅过快增加导致的不良反应。 上述算法通过闭环控制系统整合实时生物信号(如局部场电位LFPs)与行为学数据(如步态冻结事件),形成动态调控网络,最终实现症状改善与副作用风险的最优平衡。
aDBS有效性的潜在机制
由β频带能量驱动的丘脑底核神经自适应性脑深部电刺激(STN-NaDBS)仍是探索性研究的核心基础,而将β波振荡作为相关生物标志物整合应用,已被广泛认可为运动症状控制的标准方案。β频带能量升高及持续性β能量爆发会阻碍基底节-丘脑-皮层回路中的信息传递。连续脑深部电刺激(cDBS)通过抑制该回路中病理性震荡的传播来改善症状,但其无法区分β频带能量是生理性还是病理性的。β振荡活动会因多种因素(包括自主运动、昼夜节律及aDBS刺激本身)发生波动。β频带驱动的aDBS根据病理性振荡程度调整电刺激幅度。无论是在毫秒级响应速度截断持续性病理性β能量爆发(如:快速开关的单阈值控制),还是在秒至分钟时间尺度上维持适宜的β能量范围(如双阈值/比例控制),直接响应中尺度层面上的基础病理生理学。通过特异性靶向病理性震荡而非通过持续高强度电刺激目标靶点,aDBS可保留部分关键的感觉运动信息处理功能,并可能实现对运动症状更优的控制。 aDBS根据实际需求动态调整刺激输出的这种特性可能使其疗效优于cDBS。对于因异动症等不良反应限制cDBS幅度的帕金森病患者(PwP),aDBS可针对升高的β能量自适应扩大治疗窗口至更高幅度,从而在不诱发异动症风险的前提下增加总输出电能。aDBS降低TEED的能力可能使其对DBS诱发的构音障碍患者较cDBS更具获益,因该症状可能是高强度电刺激侵犯内囊的结果。初步病例研究还表明,aDBS与cDBS均可改善序列效应(即运动幅度或速度的进行性降低),且aDBS在改善步态序列效应方面可能更具优势。通过精准检测目标病理性震荡,有望优化这些早期疗效机制,实现更易耐受且高效的治疗方案。从数月到数年的治疗周期来看,这种基于生理学的神经调控能否带来更持久的疗效仍需验证。例如,已知运动迟缓和轴性症状对cDBS的反应随时间减弱,aDBS能否延长DBS对这些症状的疗效仍是重大未知问题。 当然对于β频带驱动的自适应脑深部电刺激仍有其局限性。如:β振荡活动会因多种因素波动、帕金森患者个体差异、β波段振荡无法反映其他运动症状(包括震颤和异动症)、部分患者β振荡不明显等等。拓展整合β震荡以外涵盖所有PD表型的多模式生物标志物,从而优化加强自适应脑深部电刺激系统。该类系统的可行性研究对于最终实现更优化的aDBS治疗具有重要意义。 基于数据驱动方案持续解码症状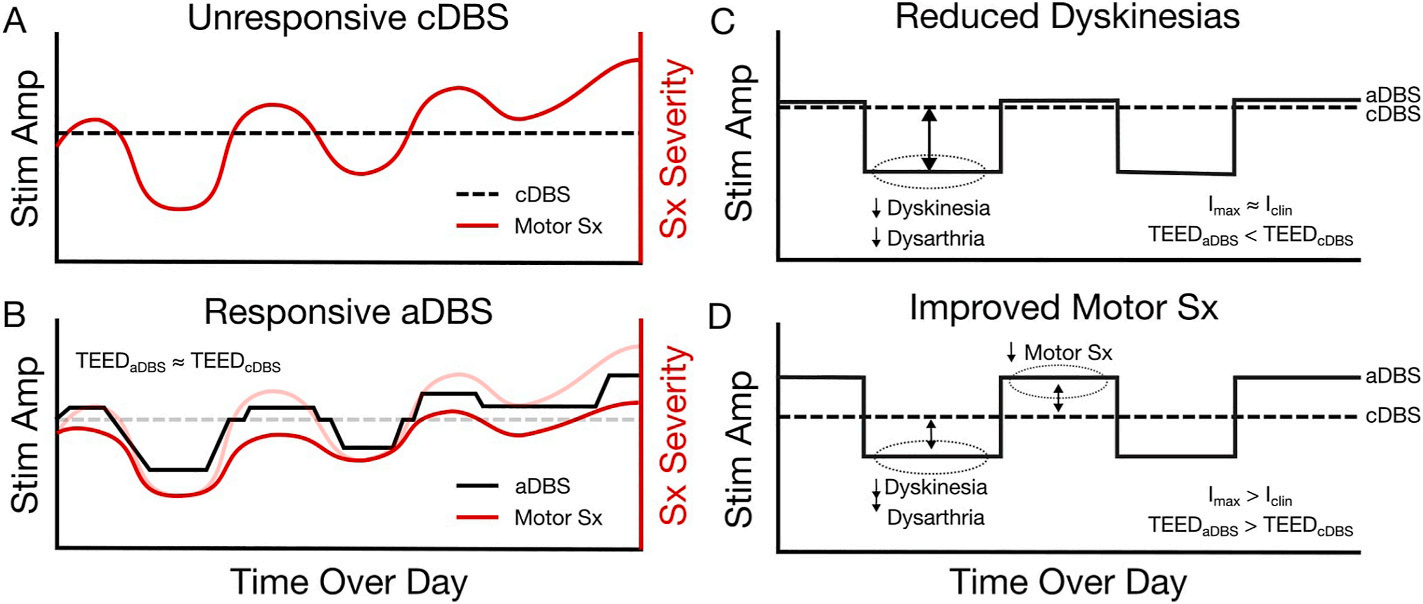
近期有研究通过利用数据驱动方法解决当前自适应脑深部电刺激(aDBS)生物标志物的局限性。将生理反馈作为输入源以指导自适应调节的能力,推动了利用机器学习或深度学习模型从神经信号中识别特定疾病状态的研究。通过对神经活动和运动表现的同步连续记录,同步模型训练,以预测给定神经信号的症状表现,解码生物标志物的相关性。已有研究针对不同的模型方法来实现数据驱动方法,每个用例都涉及一个独特的运动任务,模型从中提取特征,从输入的神经信号中解码相关的运动状态。 震颤: 针对静止性震颤的数据驱动方法,通过定量测量震颤活动并结合皮层下和皮层局部场电位(LFPs)进行分析。为解析静止性震颤相关的神经活动,研究人员会在震颤最显著的身体部位安装表面肌电信号(sEMG)和惯性测量单元(IMU)传感器,从而准确区分震颤与非震颤状态。通过将丘脑底核(STN)局部场电位与手持加速度计数据结合,作为静止状态下震颤与非震颤状态的判断指标,基于逻辑回归的分类器可预测静止性震颤的发生。将其分别整合到自适应脑深部电刺激中,有望单独使用或与并行控制器联用来抑制帕金森病患者的震颤症状,靶向运动迟缓和肌肉僵硬等典型症状。 鉴于DBS电极仅限于皮层下深部信号采集,皮层脑电(ECoG)数据驱动方案也被探索应用。使用XGBoost模型,ECoG和STNLFPs可以预测握力挤压任务中的握力。当整合STN和皮层信号输入时,XGBoost还可以区分静止性震颤、无震颤静止状态与自主运动状态。还有研究通过在静止性震颤、手指运动、手部运动及打字任务中对ECoG与STNLFPs进行主成分分析(PCA)和贝叶斯优化,首次展示了运动响应性aDBS算法的临床疗效。这些皮质下与皮层信号结合的实例提示,数据驱动方法有望解决震颤主导表型中皮质下β活动与震颤不相关的根本局限。 运动不能、强直: 利用数据驱动方法对帕金森病(PD)运动不能-强直亚型的研究围绕肌强直与运动不能的运动分析展开。通过腕部肌电图(EMG)和惯性测量单元(IMU)传感器记录手腕的自然手部旋转运动。研究发现,应用梯度提升树模型算法学习STN局部场电位和脑磁图(MEG)数据时,预测运动障碍和肌强直症状改善的关键因素是:在执行目标抓取和按钮按压任务时,丘脑底核的高β波能量成为最重要的局部特征。此外,包括STN与顶叶皮层间相干性在内的连接特征,通过这些模型可预测DBS疗效,提示需进一步探索涉及顶叶结构的神经网络。由IMU导出的运动记录可扩展到有效程控辅助工具的范畴,甚至可能实现自主校准。未来研究中采用这些模型并结合持续运动记录,将有助于aDBS参数的即时调节。 步态功能: 目前已有研究采用数据驱动方法深入解析步态功能的神经机制。在帕金森病患者中,步态障碍和冻结步态(FOG)的临床诊断面临一个普遍难题:患者在开放空间、无障碍物的医疗环境中往往难以显现这些症状。为此,科研人员专门设计了多项步态测试任务,用于检测和量化患者的FOG表现。其一为重复原地踏步(SIP)任务:受试者被限制在封闭环境中,通过双力板进行持续踏步运动,此时外界感官信息极为有限。通过同步记录SIP任务中获取的STN-LFPs与步行动力学数据,“神经步态网络”(N2GNet)——一个结合卷积神经网络(CNN)与长短期记忆网络(LSTM)的深度学习模型,能够将连续的STN-LFPs映射至支撑踏步的重心转移过程。N2GNet强调了除β活动外广泛神经活动对步态预测的贡献。另一深度神经网络模型将受控膝伸展过程中STN-LFPs的时频图与腿部肌肉发力数据输入CNN,可预测步行中的腿部肌肉协同。数据驱动方法的这种多功能性(有望通过单个触点解码疾病状态)最大化了输入信息的效用,增强了闭环刺激效果。这些模型的积极结果证明了从神经记录中解码多种运动症状能力的提升,并将生物标志物检测范围扩展至皮质下β活动之外(表1)。尽管已有这些成功案例,相关研究主要在无刺激条件下开展。由于关闭刺激(OFF)期间与精确症状分类最相关的神经特征,可能与开启刺激(ON)期间不同,因此需进一步研究刺激调节与神经信号解码的相互作用。数据驱动方法为个性化治疗铺平道路,其利用个体化生物标志物与控制策略,靶向神经或运动学标志物,甚至整合多模态输入。 其他定量运动任务已通过帕金森病症状验证,可为未来数据驱动疗法提供参考。通过在手背佩戴IMU传感器进行重复性腕部屈伸动作测试能有效监测运动迟缓症状及其随时间推移的恶化程度。而定量数字描记法则通过重复交替手指敲击任务,为帕金森病所有运动症状提供了经过验证的评估指标。转弯与障碍物行走测试(TBC)在正向行走时会引发步态异常和冻结步态(FOG)。该测试要求受试者在障碍物间进行椭圆和八字形行走,模拟现实场景中有限视觉条件下绕过障碍物的操作。总体而言,这些任务与评估指标是数据驱动方法的重要组成部分,能够精准量化症状严重程度并促进神经解码,并有望为aDBS程控提供更高效的校准依据。 未来方向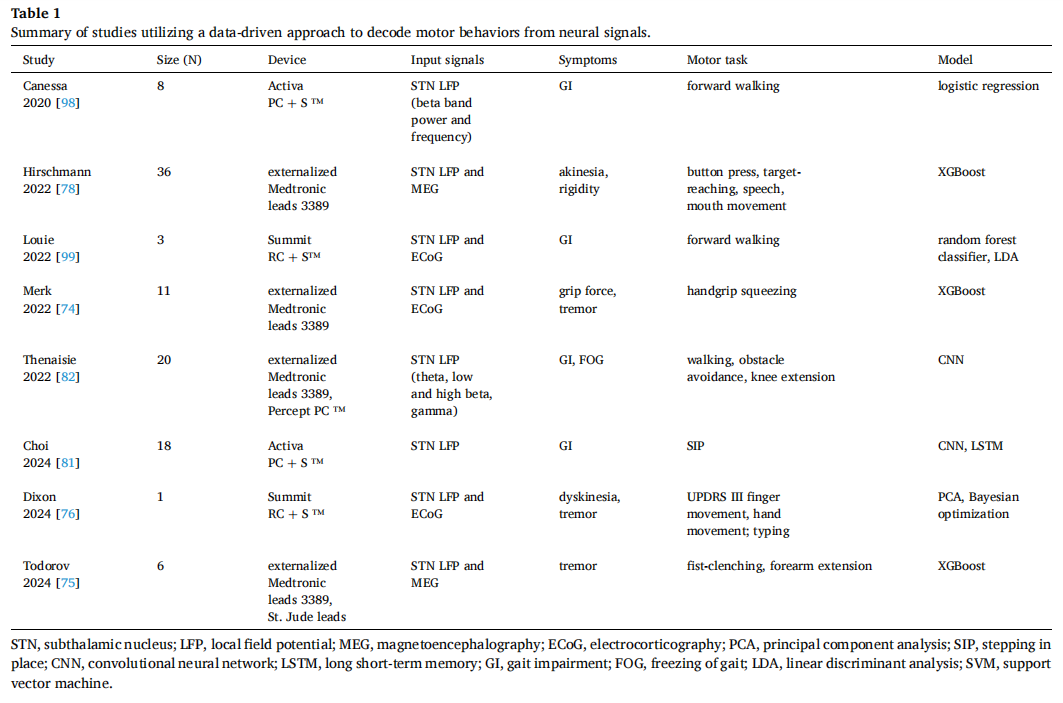
通过整合多种输入源,自适应脑深部电刺激(aDBS)系统可在不同场景下实时针对个体帕金森病患者(PwP)进行定制。数据驱动技术可处理并解读这些方式产生的复杂高维数据。然而,未来需要开展研究,在提供更直观的实时状态预测的同时降低高算法成本。此外,由于硬件限制,当前的自适应脑深部电刺激设备可能无法处理来自多种方式的连续实时数据流。内存容量、电池寿命和实时处理能力可能限制长期电刺激治疗。解决这些技术限制并简化校准流程,对于自适应脑深部电刺激系统的广泛临床应用至关重要。 未来的自适应的脑深部电刺激(aDBS)系统可考虑整合非运动症状及电刺激的副作用,以进一步针对患者定制系统。尽管当前系统主要调节刺激幅度,后续版本可拓展至频率、脉宽或触点选择的调控。控制器也可根据输入信号进行优化调整。采用更先进的混合控制器控制策略,将神经活动数据与运动学参数作为刺激输入源。机器学习技术还能辅助构建自适应算法,通过实时监测患者状态,动态调整生物标志物或控制变量的阈值。 为减轻植入式设备的负担,采用单个植入式硬件系统配合多模态算法方案,可有效突破当前脑深部电刺激(cDBS)技术的若干瓶颈。通过整合可穿戴传感器与植入装置,实现多模态反馈机制,使刺激不仅能响应脑部活动,还能根据运动状态和行为特征进行动态调整。
参考文献: Acharyya P, Daley KW, Choi JW, Wilkins KB, Karjagi S, Cui C, Seo G, Abay AK, Bronte-Stewart HM. Closing the loop in DBS: A data-driven approach. Parkinsonism Relat Disord. 2025 May;134:107348. doi: 10.1016/j.parkreldis.2025.107348. Epub 2025 Feb 21. PMID: 40037940; PMCID: PMC12356502.