学术前沿 | 丘脑立体定向脑电图用于神经调控靶点选择:概念验证及丘脑枕核直接电刺激文献综述
来自:学术前沿 日期:2025-06-23 13:20
关键信息速览
对于药物难治性癫痫(DRE)且不适合切除手术的患者,包括前核(ANT)、中央中核(CM)和枕核(PU)在内的多种丘脑核团已被广泛探索作为神经调控靶点。然而,不同丘脑靶点对各类癫痫的神经调控疗效尚不明确。本研究纳入一例32岁双侧颞顶枕叶多灶性癫痫伴皮质发育畸形(MCDs)患者,通过双侧SEEG电极记录上述三个丘脑核团的直接电刺激(DES)效应。结果显示,枕核刺激后同侧及对侧半球后象限区域的发作间期癫痫样放电(IEDs)率较基线显著降低(33%)。此外,我们对枕核丘脑刺激治疗DRE的现有证据进行了范围综述。结果表明,不同丘脑靶点的神经调控效果因致痫区(EZs)而异。对于存在广泛MCDs的多灶性EZs患者,可通过丘脑SEEG电极引导的DES实现个体化丘脑电刺激靶点选择。
前言
全球约6500万癫痫患者中,三分之一为药物难治性癫痫(DRE)。癫痫外科切除手术是减少/减轻发作、改善生活质量及提高劳动能力的最有效手段。然而,由于致痫区(EZs)与重要功能皮质重叠或存在单侧/双侧广泛EZs,多数患者无法接受切除性手术。作为替代方案,丘脑神经电刺激调控已被提议作为姑息性治疗选择。高频电刺激丘脑前核(ANT)在治疗耐药性颞叶癫痫中具有一级证据支持。近期研究表明,枕核(PU)和中央中核(CM)可能是多种癫痫类型的潜在新靶点。然而,由于缺乏对照临床试验,不同丘脑靶点在局灶性或全面性癫痫中的差异化疗效尚未明确。此外,既往研究未报道同一癫痫网络内不同丘脑核团直接电刺激(DES)对发作间期癫痫样放电(IEDs)的影响。本研究通过双侧SEEG电极对三个丘脑核团进行DES,探讨其对多灶性双侧颞顶枕叶癫痫患者IEDs的差异化影响,并通过文献综述阐明枕核电刺激在DRE治疗中的现状。 研究方案
在一例接受SEEG植入以定位致痫区(EZ)的药物难治性癫痫(DRE)患者中,深部电极(SEEG)被植入至三个丘脑区域(枕核[PU]、中央中核[CM]和前核[ANT])。对不同丘脑核团进行直接电刺激(DES),并同步采集了SEEG皮层接触点的电信号。本报告中,我们采用1Hz、50Hz和100Hz的刺激频率以区分低频与高频刺激效应。然而,内特斯尼高力SEEG适配的脑电检测仪仅支持最高100Hz的刺激频率输出。因此,作者通过100Hz刺激模拟145Hz刺激的影响(假设50Hz刺激未观察到副作用)。每个丘脑靶点的DES试验间隔至少2小时。每次试验包含以下参数组合: 1) 50Hz:脉宽300µs,电流强度1–2mA,电荷密度6–12μC/cm2,持续时间4s; 2) 100Hz:脉宽300µs,电流强度1–2mA,电荷密度6–12μC/cm2,持续时间4s; 3) 1Hz:脉宽1000µs,电流强度1–2mA,电荷密度20–40μC/cm2,持续时间30s。 每次不同参数和触点刺激之间至少间隔2分钟。分析区域包括:舌回、顶下小叶、海马体头部及中央前回下部。共获取46次刺激试验的368组记录,涵盖两种刺激强度、三种频率、双侧刺激(左/右)及四个丘脑位点(ANT、CM、内侧和外侧PU)。采用AnyWave软件的Delphos算法自动检测IEDs,其敏感性>80%,特异性接近100%。通过计数ANT、CM和PU每次刺激后30秒及60秒内的IEDs,并与刺激前30分钟的基线IEDs对比,计算IED变化率: (刺激后的IEDs数量 /基线IEDs数量– 1) ×100。(IED减少≥33%为显著降低) 并且对相关文献进行综述研究:依据PRISMA-ScR指南,在MEDLINE和Embase数据库中检索关键词组合“PU, stimulation, and epilepsy ”和“ PU and electrical stimulation”,限定英语文献及人体研究。排除实验性研究、生理学研究、磁刺激研究、仅关注PU以外的其他丘脑核团或未提供原始数据(如综述类)的文献。从符合纳入标准的文献中提取患者特征、癫痫病因、致痫区、干预参数及预后数据。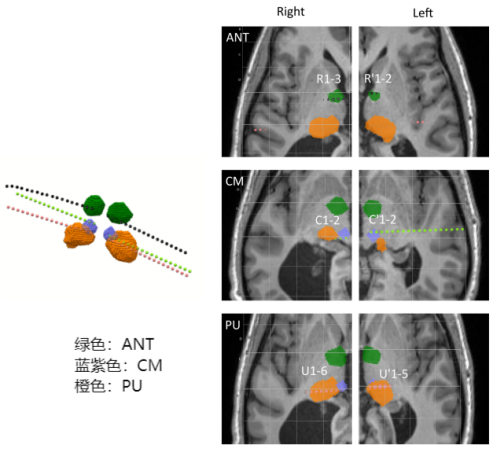
结果
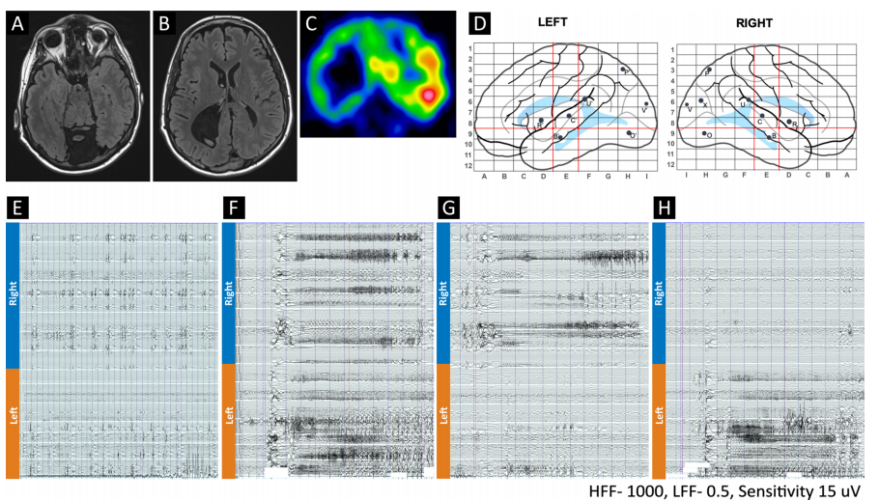
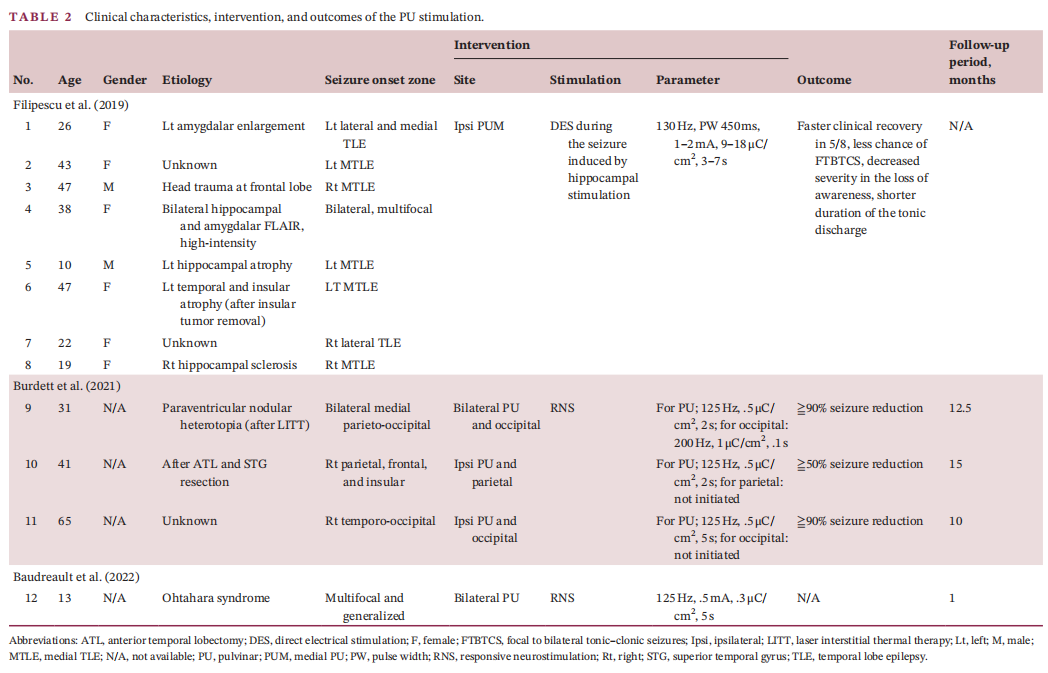
(1)病例介绍 患者为32岁男性,自5岁起患DRE,合并Dandy-Walker综合征、注意力缺陷多动障碍、全面性发育迟缓。视频脑电显示双侧独立起源的多发性癫痫发作(局灶性意识障碍性发作),发作起始于双侧中央颞-顶区及颞顶枕区,伴行为停滞,且未因逐渐减量抗癫痫药物(ASMs)而改变发作模式。6种抗癫痫药物联合迷走神经刺激术可控制继发性全面性强直阵挛发作,但患者每周仍出现2-3次行为停滞。磁共振成像(MRI)显示广泛双侧(右侧较左侧更显著)灰质异位合并多小脑回畸形,累及颞顶枕区。为确认双侧颞顶枕区癫痫发作起始区(EZs),并探索脑深部电刺激术(DBS)或反应性神经刺激术(RNS)的潜在丘脑靶点,行立体定向脑电图(SEEG)检查。61次发作期数据显示双侧颞顶枕区多发致痫灶。给予不同参数的丘脑核团电刺激以寻找目标刺激靶点及评估刺激耐受性。 (2)刺激后IED变化 刺激后30秒IED(发作间期癫痫样放电)减少率显著高于60秒(30秒vs.60秒:199/368 vs.158/368,p=0.003)。总体而言,三个丘脑核团刺激后双侧后象限区域的IED减少最为显著,其中枕核刺激效果最佳。50Hz与100Hz刺激的IED减少率显著高于1Hz刺激。患者未报告任何刺激相关副作用(≤2mA,40μC/cm²)。 (3)术后临床随访 根据SEEG植入后电刺激结果,患者在枕核(PU)处植入闭环神经刺激电极(RNS)。治疗后2年达到Engel IIB级预后(电流1.8 mA、频率125 Hz、脉宽160μs、电荷密度0.9μC/cm²、刺激时长3s),发作频率减少>75%,抗癫痫药物(ASMs)从6种减至5种。患者自述术后未再因癫痫缺勤,且术后2年成功完成为期2周的欧洲背包旅行(术前无法实现)。 (4)文献综述 在235篇文献中,共纳入3项研究(12例患者)。10例患者刺激侧与致痫区同侧,2例为双侧刺激。所有研究均采用>100Hz频率刺激。在8例颞叶内侧癫痫患者中,6例通过内侧枕核刺激减少发作频率,减轻发作严重程度。3例涉及后象限区域药物难治性癫痫患者接受了枕核联合皮质RNS后,发作频率均减少≥50%。 结语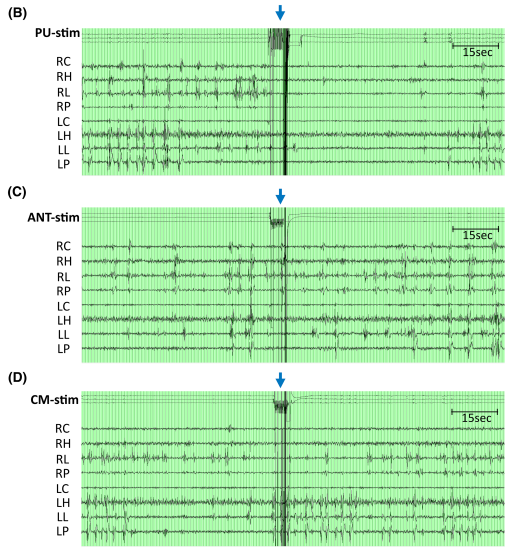
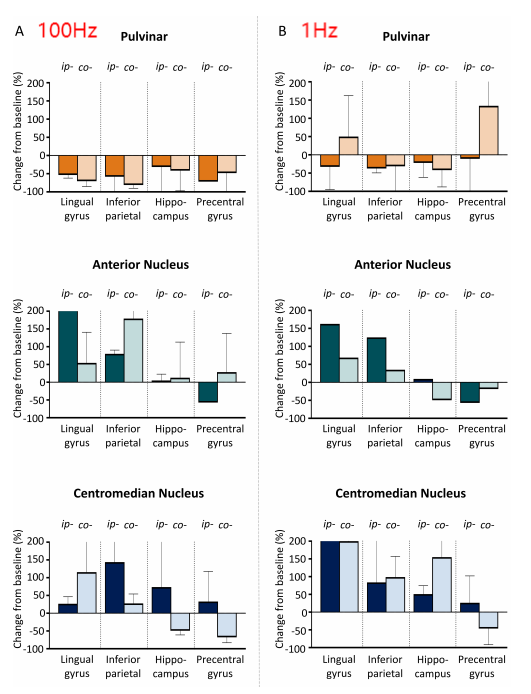

本研究首次证实不同丘脑核团DES对IEDs的差异化调控作用。本病例报告验证了基于立体脑电图(SEEG)的枕核(PU)直接电刺激在调节发作间期癫痫样放电(IEDs)中的临床可行性。这些发现强调了通过探索基于立体脑电图(SEEG)的丘脑深部电刺激对发作间期癫痫样放电(IEDs)的影响来实施个体化神经调控的潜在价值,尤其适用于存在多灶性及广泛性皮层发育畸形的患者。在三个丘脑核团中,枕核(PU)刺激对后象限区域的发作间期癫痫样放电(IEDs)具有最显著的抑制作用。在后续的长期临床随访也证实了该方法的有效性。 未来,基于立体脑电图(SEEG)的脑深部电刺激(DES)或可协助探索药物难治性癫痫(DRE)患者的闭环神经电刺激(RNS)目标刺激靶点的选择及切除性治疗方案等。
参考文献:Ikegaya N, Aung T, Mallela A, Hect JL, Damiani A, Gonzalez-Martinez JA. Thalamic stereoelectroencephalography for neuromodulation target selection: Proof of concept and review of literature of pulvinar direct electrical stimulation. Epilepsia. 2024 Jun;65(6):e79-e86. doi: 10.1111/epi.17986. Epub 2024 Apr 16. PMID: 38625609.